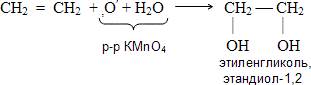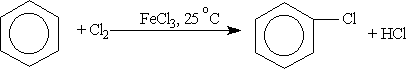Особенности проведения уроков по химии с историческим содержанием
Урок 2.
Непредельные углеводороды. Алкены.
Задачи:
Образовательная.
Вспомнить общую формулу алкенов, знать их физические и химические свойства, уметь записывать молекулярные и структурные формулы алкенов, называть вещества по систематической номенклатуре, отработать навыки решения задач на нахождение молекулярной формулы.
Воспитательная.
Продолжить формирование у учащихся научной картины мира в процессе изучения строения и свойств непредельных углеводородов, а также их отдельных представителей. Воспитывать желание учиться активно, с интересом, прививать сознательную дисциплинированность, четкость и организованность в работе.
Развивающая.
Развивать умение учащихся на основе теоретических знаний сравнивать, анализировать, обобщать, логически рассуждать, устанавливать взаимосвязь строения и свойств веществ, умения составлять уравнения химических реакций с участием непредельных углеводородов.
ФОУД: урок.
Тип урока: изучение нового материала.
Ход урока:
|
Этапы и содержание урока. |
Методы и методические приёмы. | |||
|
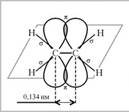
I. Мобилизующее начало урока. Организация класса, проверка отсутствующих. II. Актуализация знаний учащихся. 1. Что называется длиной связи? (Длина связи – это расстояние между центрами ядер связываемых атомов в молекуле.) 2. Что можно сказать о длине углерод-углеродной связи веществ с одинарной (С–С) и двойной (С=С) связью? (Длина углерод-углеродной одинарной связи – 0,154 нм двойной связи – 0,133 нм, двойная связь прочнее и короче одинарной.) 3. Сколько -связей может возникнуть между атомами? (Одна.) 4. Что можно сказать о прочности π-cвязи? (Она менее прочная, чем одинарная σ-связь.) 5. Какая химическая связь образуется между гибридизированными облаками? (Сигма.) 6. Сколько валентных электронов у атома углерода? (Четыре.) III. Изучение нового материала. 1. Задача. Немецкий алхимик и врач Иоганн Бехер в 1669 г., прибавив к серной кислоте этиловый спирт, наблюдал, как раствор сильно вспенился, выделяя неизвестный газ, похожий на метан. Однако в отличие от метана новый газ горел коптящим пламенем и обладал слабым чесночным запахом. Какой газ открыл Бехер, если в данном соединении массовая доля углерода составляет 85,7%, массовая доля Н – 14,3%, а плотность по водороду данного газа 14? Выведите формулу углеводорода. Решение: М(СxHу)=14 * 2=28г/моль Для 1 моль СxHу m(СxHу)=28г m(C)=28г * 0,857=24г n(C)= 24г / 12г/моль=2 моль m(H)= 28г * 0,143=4г n(H)=4г / 1г/моль=4 моль Ответ: СxHу - С2Н4 - этилен Алкены (иначе олефины или этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°(Модель молекулы этилена). Простейшим алкеном является этен (C2H4). Схема образования π-связи в молекуле этилена
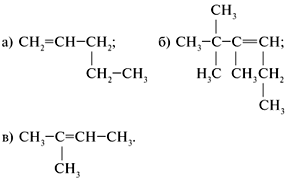
По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой. Впервые этилен был получен в 1669 году немецким химиком и врачом Бехером действием серной кислоты на этиловый спирт. Ученый установил, что его «воздух» более химически активен, чем метан, однако, идентифицировать полученный газ он не смог и названия ему не присвоил. И.И. Бехер Биография Вторично и тем же способом «воздух Бехера» был получен и описан голландскими химиками Дейманом, Потс-ван-Трооствиком, Бондом и Лауверенбургом в 1795 году. Они назвали его «маслородным газом» так как при взаимодействии с хлором, он образовывал маслянистую жидкость — дихлорэтан (об этом стало известно позднее). По-французски «маслородный» — oléfiant. Французский химик Антуан Фуркруа ввёл этот термин в практику, а когда были обнаружены другие углеводороды такого же типа, это название стало общим для всего класса олефинов (или, по современной номенклатуре, алкенов). А. Фуркруа Биография В начале XIX века французский химик Ж. Гей-Люссак обнаружил, что этанол состоит из «маслородного» газа и воды. Этот же газ он обнаружил и в хлористом этиле. В 1828 году Ж. Дюма и П. Буллей предположили, что этилен представляет собой основание, способное давать соли подобно аммиаку. Якоб Берцелиус принял эту идею, назвав соединение «этерином» и обозначив буквой E. Ж.Дюма Биография Определив, что этилен состоит из водорода и углерода, долгое время химики не могли выписать его настоящую формулу. В 1848 году Кольбе писал формулу этилена как С4Н4, этого же мнения придерживался и Либих. Ж. Дюма правильно определил состав вещества, но его структура по-прежнему была описана неверно: С2НН3. В 1862 году немецкий химик-органик Э.Эрленмейер предположил наличие в молекуле этилена двойной связи, а в 1870 году известный российский ученый А. М. Бутлеров признал эту точку зрения правильной, подтвердив её природу экспериментально. Э. Эрленмейер Биография 2. Изомерия и номенклатура алкенов Кто впервые предложил термин «изомеры»? Что такое «изомерия»? Какие виды изомерии вы знаете? Виды изомерии 1) Рассмотрим структурные формулы линейного и разветвленного алкенов, имеющих одинаковую молекулярную формулу С4Н8:
Такой вид изомерии называют изомерией углеродного скелета. 2) Изомерия положения кратной связи:
3) Изомерия разных гомологических рядов. Общая формула СnH2n соответствует двум гомологическим рядам: алкенам и циклопарафинам. Например, формула С4Н8 может принадлежать соединениям разных классов:
4) Пространственная или геометрическая изомерия. У бутена-2 СН3–СН=СН–СН3 каждый углерод при двойной связи имеет разные заместители (Н и СН3). В таких случаях для алкенов возможна цистрансизомерия. Если элементы главной углеродной цепи находятся по одну сторону от двойной связи в плоскости молекулы, то это цисизомер; если по разные стороны, то это трансизомер:
3. Получение алкенов. 1) Дегидратация спиртов (демонстрационный опыт получения этилена из этилового спирта):
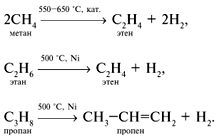
2) Дегидрирование алканов:
3) Пиролиз и крекинг нефти и природного газа:
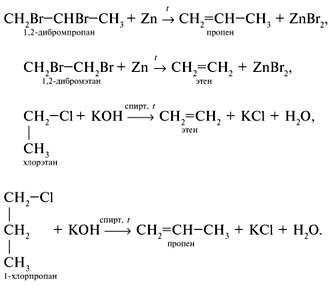
4) Из галогенопроизводных алканов:
5) Дегидрогалогенирование (отщепление галогенводорода)
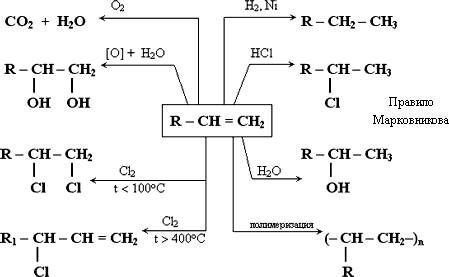
При отщеплении галогенводорода образуется смесь изомеров, преобладающий из которых определяется правилом Зайцева: при отщеплении галогенводорода от вторичных и третичных алкилгалогенидов атом водорода отрывается от наименее гидрированного атома углерода. Зайцев 4. Физические свойства алкенов. Алкены – этен, пропен и бутен – при обычных условиях (20 °С, 1 атм) – газы, от С5Н10 до С18Н36 – жидкости, высшие алкены – твердые вещества. Алкены нерастворимы в воде, хорошо растворимы в органических растворителях. 5. Химические свойства. Какие типы реакций вы знаете? В органической химии рассматривают три типа химических реакций: замещение, присоединение и разложение. 1) Для алкенов характерны реакции присоединения. Присоединение водорода (гидрирование):
Присоединение галогеноводородов:
Правило Марковникова: В реакциях присоединения молекул сложных веществ типа НХ (Х – F, Cl, Br, I, OH- и др.) к несимметричным алкенам атом водорода присоединяется к более гидрированному атому углерода при двойной связи. Например:
Реакция идет по ионному механизму. В.В. Марковников Биография Присоединение воды (гидратация):
Задача. В 1854 году французский химик Марселен Бертло открыл способ получения этилового спирта С2Н5ОН без брожения пищевого сырья и без гидролиза растительных материалов вроде древесины. Он использовал реакцию получившую его имя – реакцию Бертло:
В этой реакции этилен подвергается гидротации в присутствии серной кислоты и катализатора – ртути. Определить объем этилена, который нужно взять для получения 33,7г этанола с его практическим выходом 78% ? Решение: mт(С2Н5ОН)=33,7г / 0,78 = 43,2 г n(С2Н5ОН)= 43,2г / 46г/моль=0,94 моль По уравнению реакции n(С2Н5ОН)= n(C2H4)= 0,94 моль V(C2H4)=0,94моль * 22,4л/моль = 21л Ответ: объем этилена 21л 2) Реакции окисления.
Предельные углеводороды, как вы знаете, не окисляются водным раствором перманганата калия. Алкены же окисляются с образованием гликолей (двухатомных спиртов), при этом происходит обесцвечивание фиолетового раствора перманганата калия (реакция Вагнера). Схема этой реакции:
Напишите уравнение этой реакции и расставьте коэффициенты: 3CH2 = CH2 + 2КМnО4 + 4H2О Этиленгликоль используется в качестве антифриза, из него получают волокно лавсан, взрывчатые вещества. Вагнер Е.Е. Биография Каталитическое окисление этилена кислородом – промышленный способ получения ацетальдегида:
ацетальдегид 3) Полимеризация (особый тип реакций присоединения, в которых молекулы алкенов соединяются друг с другом с образованием больших длинных молекул, макромолекул)
Инициаторами реакции выступают пероксиды. Опорная схема «Химические свойства алкенов»
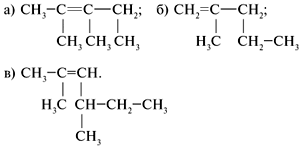
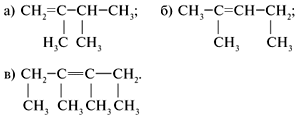
R – CH = CH2 – формула любого алкена. 6. Применение. Изучая химические свойства алкенов, вы, очевидно, поняли, что благодаря высокой реакционной способности они являются ценным сырьем для химической промышленности. На их основе получают сотни практически важных продуктов и материалов. Некоторые области применения этилена вы можете увидеть на рисунке: Применение этилена: 1- в овощехранилищах для ускорения созревания плодов; 2-6 – производство органических соединений (полиэтилена 2, растворителей 3, уксусной кислоты 4, спиртов 5, 6) IV. Закрепление. Задача: Относительное количественное содержание углерода и водорода в этилене определил Дальтон в 1805 г., хотя опубликовал свои данные лишь в 1810 г. Исходя из этих данных Дальтона и из плотности паров этилена правильную эмпирическую формулу его предложил Авогадро (1821). Определите молекулярную формулу углеводорода, который также получил опытным путем Авогадро, который содержит 85,7% углерода и имеет плотность по водороду 21. Решение M(CxHy) = D(H2)•M(H2) = 21•2 = 42 г/моль. Для n(CxHy) = 1 моль m(C) = 42•0,857 = 36 г, n(C) = 36 (г)/12 (г/моль) = 3 моль, m(Н) = 42 – 36 = 6 г, n(Н) = 6 (г)/1 (г/моль) = 6 моль. Формула углеводорода – С3Н6 (пропен). Самостоятельная работа по вариантам (5 мин) Назвать вещества. 1-вариант:
2-вариант:
3-вариант:
V. Подведение итогов урока. Запомните главное! 1. Непредельные углеводороды активно вступают в реакции присоединения. 2. Реакционная активность алкенов связана с тем, что π- связь под действием реагентов легко разрывается. 3. В результате присоединения происходит переход атомов углерода из sp2 – в sp3- гибридное состояние. Продукт реакции имеет предельный характер. 4. При нагревании этилена, пропилена и других алкенов под давлением или в присутствии катализатора их отдельные молекулы соединяются в длинные цепочки – полимеры. Полимеры (полиэтилен, полипропилен) имеют большое практическое значение. VI. Домашнее задание. (По учебнику О.С. Габриеляна) §11 выучить, ответить на вопросы с. 85 №3, 4, 6 (письменно). |
Словесный. Вводное слово учителя. Словесный Фронтальный опрос Решение задачи. Один из учеников решает у доски. Словесный Рассказ учителя. Наглядный. Демонстрация модели этилена. Словесный. Рассказ учителя. Запись в тетрадях основных дат. Словесный. Сообщение учащегося с презентацией портрета учёного. Словесный Рассказ учителя. Запись в тетрадях основных дат. Словесный. Сообщение учащегося с презентацией портрета учёного. Словесный Рассказ учителя Запись в тетрадях основных дат. Словесный. Сообщение учащегося с презентацией портрета учёного Словесный. Рассказ учителя Запись в тетрадях основных дат. Словесный. Сообщение учащегося с презентацией портрета учёного Словесный. Рассказ учителя с элементами беседы. Запись формул на доске Запись формул на доске Словесный. Рассказ учителя. Запись формул на доске Запись формул на доске. Словесный Объяснения учителя Запись уравнений реакций на доске и в тетрадях. Запись уравнений реакций на доске и в тетрадях. ловесный. Сообщение учащегося с презентацией портрета учёного Словесный. Сообщение учащегося с презентацией портрета учёного. Словесный. Объяснение учителя. Запись в тетрадях. Словесный. Рассказ учителя с элементами беседы. Наглядный. Демонстрация опытов. Запись уравнений реакций на доске и в тетрадях. Словесный. Рассказ учителя, запись уравнений реакций на доске и в тетрадях. Решение задачи, один ученик решает у доски. Запись уравнения на доске. Наглядный. Демонстрация опыта. Запись уравнений реакций на доске и в тетрадях. Написание уравнения. Проверка у доски. Словесный. Сообщение учащегося с презентацией портрета учёного. Словесный. Рассказ учителя, запись уравнений реакций на доске и в тетрадях. Совместное составление опорной схемы. Зарисовка схемы на доске и в тетрадях. Словесный Рассказ учителя с демонстрацией слайда презентации. Решение задач один ученик решает у доски. Самостоятельная работа учащихся Рассказ учителя с элементами беседы. Пояснения учителя. Запись д/з на доске. |
Урок 3.
Ароматические углеводороды.
Задачи:
Образовательная.
На примере бензола продолжить знакомство с углеводородами, которые имеют замкнутые цепи углеродных атомов; научить записывать структурную формулу бензола, закрепить умение сравнивать состав и строение углеводородов разных гомологических рядов; дать понятие об ароматической связи, её особенностях, установить взаимосвязь между строением бензола и его свойствами; познакомить с физическими свойствами бензола; сформировать знания учащихся об ароматических углеводородах, и получении, свойствах и применении на примере бензола.
Воспитательная.
В целях формирования научной картины мира, убедить учащихся в том, что бензол играет очень важную роль в жизни человека.
Развивающая.
В целях развития логического мышления (таких операций как анализ, синтез, сравнение, обобщение, умение делать выводы, устанавливать причинно следственны связи) и развития познавательного интереса использовать электронную презентацию, демонстрационные эксперименты (видео) «Физические свойства бензола», «Отношение бензола к бромной воде и перманганату калия», «Горение бензола», «Бромирование бензола» «Нитрование бензола» и «Хлорирование бензола (на свету)».
ФОУД: урок.
Тип урока: изучение нового материала.
Вид урока: с использованием электронной презентации с демонстрацией опытов.
Оборудование: медиапроектор и электронная презентация по теме «Арены»
Ход урока:
|
Этапы и содержание урока. |
Методы и методические приёмы. |
|
I.Мобилизующее начало урока. Организация класса, проверка отсутствующих. II. Актуализация знаний учащихся. Какие вещества мы называем углеводородами? Углеводороды – соединения, состоящие только из атомов основных органогенов – углерода и водорода. Какие вещества мы называем ароматическими? III. Изучение нового материала. Определение аренов Арены - циклические углеводороды, содержащие особую группировку атомов С6Н6 и отвечающие общей формуле СnH2n-6 Первым представителем аренов является- бензол. Исторический очерк История открытия бензола весьма интересна. В 1812 – 1815 годах в Лондоне впервые появилось газовое освещение. Светильный газ, добывавшийся из жира морских животных, доставлялся в железных баллонах. Эти баллоны помещались обычно в подвале дома, из них газ по трубкам распределялся по всему помещению. Вскоре было замечено крайне неприятное обстоятельство – в сильные холода газ терял способность давать при горении яркий свет. Владельцы газового завода в 1825 г. Обратились за советом к Фарадею, который нашёл, что те составные части, которые способны гореть ярким пламенем, собираются на дне баллона в виде прозрачного жидкого слоя. При исследовании этой жидкости Фарадей открыл новый углеводород – бензол. Название этому веществу дал Либих – (суффикс –ол указывает на его маслянистый характер, от латинского oleum – масло). Задача: При сжигании 2,5 г вещества выделилось 8,46 г углекислого газа и 1,73 г воды. Масса 1 л вещества составляет 3,5 г. Определите молекулярную и возможную структурную формулы вещества. Решая задачу, учащиеся выводят молекулярную формулу вещества – С6Н6. Возникает проблемная ситуация: “Какое строение может иметь молекула бензола?” Опираясь на знание о непредельных углеводородах, учащиеся предлагают возможные структурные формулы для него: НС Н2С = СН —С Учащиеся делают вывод о том, что бензол является сильно ненасыщенным соединением, вспоминают качественные реакции на непредельность. 2. Состав бензола. Его молекулярная формула – С6Н6 В 1865 г. Немецким учёным Кекуле была предложена структура молекулы бензола, которая приснилась ему в виде змеи, укусившей себя за хвост.
Исторический очерк Фридрих Август Кекуле (1829-1896 гг.) Немецкий химик-органик. Предложил структурную формулу молекулы бензола. С целью проверки гипотезы о равноценности всех шести атомов водорода в молекуле бензола получил его галоген-, нитро-, амино-и карбоксипроизводные. Но формула, предложенная Кекуле, соответствуя элементарному составу бензола, не отвечает многим его особенностям: бензол не даёт качественных реакций на непредельность; для бензола характерны реакции замещения, а не присоединения; формула Кекуле не в состоянии объяснить равенства расстояний между углеродными атомами, что имеет место в реальной молекуле бензола. Чтобы выйти из этого затруднения, Кекуле допустил, что в бензоле происходит непрерывное перемещение двойных связей.
И только использование современных физических и квантовых методов исследования дало возможность создать исчерпывающее представление о строении бензола. 3. Строение бензола Атомы углерода в молекуле бензола находятся во втором валентном состоянии (sp2). Каждый атом углерода образует Каждый атом углерода имеет одну негибридную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскости В результате такого равномерного перекрывания 2р-орбиталей всех шести углеродных атомов происходит “выравнивание” простых и двойных связей – длина связи составляет 0,139 нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154 нм) и длиной двойной связи в алкенах (0,133 нм). То есть, в молекуле бензола отсутствуют классические двойные и одинарные связи. Равноценность связей принято изображать кружком внутри цикла (см. рис. В). Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения — количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола. В настоящее время нет единого способа графического изображения молекулы бензола с учётом его реальных свойств. Но, чтобы подчеркнуть выравненность 4. Номенклатура. Основой названия ароматического углеводорода с небольшими заместителями является слово «бензол». Атомы в ароматическом кольце нумеруют от старшего заместителя к младшему. Если заместители одинаковы, то нумерацию проводят по самому короткому пути. 5. Физические свойства бензола. Бензол – это жидкость, может находиться и в парообразном состоянии. Бензол является сильно токсичным веществом. Вдыхание его паров вызывает головокружение и головную боль. При высоких концентрациях бензола возможны случаи потери сознания. Его пары раздражают глаза и слизистую оболочку. Жидкий бензол легко проникает в организм через кожу, что может привести к отравлению. Поэтому работа с бензолом и его гомологами требует особой осторожности. 6. Химические свойства бензола. А) Реакция горения: 2С6Н6 +15О2 = 12 СО2 +6Н2О Содержание углерода в бензоле около 92%. В обычных условиях полного сгорания не происходит. При неполном сгорании образуется много копоти. Бензол легко загорается и горит ярким пламенем. Копоть – это несгоревшие частицы углерода, при горении они раскаляются и увеличивают светимость пламени. Б) Реакции замещения: Для разрыва ароматической системы аренов необходимо затратить большую энергию, поэтому арены вступают в реакции присоединения только в жестких условиях: при значительном повышении температуры или в присутствии очень активных реагентов. В связи с этим, наиболее характерными для них будут реакции замещения атомов водорода, протекающие с сохранением ароматической системы. Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов — безводных АlСl3, FeСl3, АlВr3. В результате реакции образуются галогенозамещенные арены:
Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии так называемой нитрующей смеси (смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
В) Реакции присоединения
7. Получение Арены получают главным образом при сухой перегонке каменного угля. При нагревании каменного угля в ретортах или коксовальных печах без доступа воздуха при 1000 – 1300 0С происходит разложение органических веществ каменного угля с образованием твердых, жидких и газообразных продуктов. Альтернативным источником получения аренов служит древесина. В самой древесине аренов нет, однако при ее пиролизе они образуются и могут быть выделены. В странах богатых нефтью арены получают при ее переработке. Нефтяные продукты нагревают при температуре 700 0С, в результате чего из продуктов разложения нефти удается получить 15-18% аренов. Также бензол можно получить реакцией тримеризации (реакция Зелинского): И реакцией дегидрирования гексана
Зелинский Биография. 8. Применение. Бензол входит в десятку важнейших веществ химической промышленности. Большую часть получаемого бензола используют для синтеза других продуктов: около 50 % бензола превращают в этилбензол (алкилирование бензола этиленом); около 25 % бензола превращают в кумол (алкилирование бензола пропиленом); приблизительно 10—15 % бензола гидрируют в циклогексан; около 10 % бензола расходуется на производство нитробензола; 2—3 % бензола превращают в линейные алкилбензолы; приблизительно 1 % бензола используется для синтеза хлорбензола. В существенно меньших количествах бензол используется для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используется в качестве растворителя. Кроме того, бензол входит в состав бензина. Ввиду высокой токсичности его содержание новыми стандартами ограничено введением до 1%. IV. Домашнее задание. Параграф №15 стр.116 №1, 3,4 (письменно) Какие свойства бензола лежат в основе его применения? Для любознательных Узнайте названия растворителей и внимательно изучите состав растворителей по этикеткам. Как соотносится токсичность бензола с использованием в качестве компонента бытовых растворителей? V. Подведение итогов урока. В 1855 году Шарль Адольф Вюрц предложил общий способ (позже названный именем Вюрца) синтеза насыщенных углеводородов действием металлического натрия на алкилгалогениды(обычно бромиды или иодиды). Вильгельм Рудольф Фиттиг распространил реакцию Вюрца на область ароматических углеводородов (реакция Вюрца — Фиттига). Напишите уравнения реакций: А) Бромистого этила и йодистого бутила с натрием. Б) Образования метилбензола и бутилбензола по методу Вюрца — Фиттига . Решение: А) 2CH3–CH2Br(бромистый этил) + 2Na ––> CH3–CH2–CH2–CH3(бутан) + 2NaBr
C6H5Br + 2Na + ВrC4H9 → С6Н5-С4Н9+ 2NaВr |
Словесный. Вводное слово учителя. Слайд 1 «Ароматические углеводороды» Словесный. Беседа Словесный метод Рассказ учителя С использованием электронной презентации Наглядный метод Демонстрация слайда 2 презентации Использование исторического подхода. Демонстрация слайда 4 презентации Демонстрация слайда 5 презентации Демонстрация слайда 6 презентации Использование исторического подхода Опыт «Отношение бензола к бромной воде и перманганату» Демонстрация слайда 7 презентации Наглядный метод Демонстрация шаростержневой модели молекулы бензола и Демонстрация слайда 8 презентации Демонстрация слайда 9 презентации Наглядный метод Демонстрация слайда 10 презентации Словесный метод Рассказ учителя Запись определения учащимися в тетради. Демонстрация слайда 11 презентации Наглядный метод Демонстрация слайда 12 презентации Демонстрация слайда 13 презентации Демонстрационный опыт «Физические свойства бензола». Демонстрация слайда 14 презентации Демонстрационный опыт «Горение брома» Демонстрация слайда 15 презентации Демонстрация слайда 16 презентации Демонстрационный опыт «Бромирование бензола» Демонстрация слайда 17 презентации Демонстрационный опыт «Нитрование бензола» Демонстрация слайда 18 презентации Демонстрационный опыт «Хлорирование бензола на свету» Сообщение ученика по предварительной работе. Демонстрация слайда 19 презентации Сообщение ученика по предварительной работе. Сообщение ученика по предварительной работе. Демонстрация слайда 20 презентации Демонстрация слайда 21 презентации Запись в дневниках Демонстрация слайда 22 презентации |
Нами также
Познавательно о обучении:
Реализация структурных элементов урока информатики
с учетом методов психологического воздействия
Прежде, чем говорить о реализации методов психологического воздействия, определим понятия «урок» и «структура урока». Урок – это такая форма организации педагогического процесса, при которой педагог, в течение точно установленного времени руководит, познавательной коллективной и иной деятельностью ...
Особенности проведения занятий при эндокринных
заболеваниях
Необходимо учитывать следующие особенности состояния организма при организации физической подготовки: нарушение всех видов обмена (в том числе водного, минерального и витаминного) при преимущественном нарушении одного из них; ослабление силы и тонуса мышц; функциональная слабость всех систем и орга ...
Виды и формы деятельности
коллективно-творческие дела; игровые программы, игры, конкурсы, концерты; индивидуальные и групповые беседы; психологические тренинги; командная (отрядная) работа; работа в классах – мастерских; нетрадиционные формы работы. Основные службы, обеспечивающие полноценную жизнь Лагеря общения Педколлект ...
Категории
- Главная
- Основы педагогического мастерства
- Современные модели обучения
- Организация науки в Украине
- Воспитание нравственности в современной школе
- Развитие технологической культуры учащихся
- Развитие речи дошкольников
- Новая педагогика
- Карта сайта


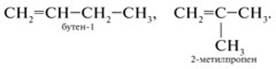
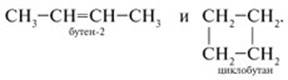
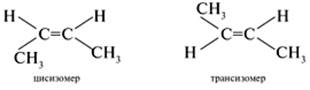

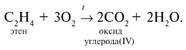 Горение:
Горение: